от которых зависят концентрации реагентов,
Автоматизация реакторных процессов (ч.1)
Упрощенная структурная схема химического реактора.

Рис.1.1.
- Химический процесс (3) определяется:
- взаимодействием гидродинамических, массообменных и тепловых процессов в аппарате,
- от которых зависят концентрации реагентов, температура q и давление Р реакторного процесса.
- Химические превращения (3) приводят к изменению тепловых (2) и гидродинамических процессов (1) в реакторе.
- Определение характера процессов, протекающих в реакторе, на основе анализа соотношения между скоростью химической реакции r и скоростью материального обмена rобм.

Ø процесс идет в кинетической области;
Ø скорость процесса определяет химическое взаимодействие;
Ø массообмен не влияет на скорость химической реакции.
2. При

Ø процесс идет в диффузионной области;
Ø процесс характеризуется массообменом;
Ø определяющей стадией является транспорт реагирующих веществ.
3. При

Ø процесс идет в переходной области;
Ø скорость процесса является сложной функцией реакционно-кинетических и диффузионных зависимостей.
Показатели эффективности реакторного процесса.
- Степень превращения.
- Степень превращения Un , представленная через мольные доли:

где n0 - число молей компонента в исходном потоке;
n - число молей компонента в реакционной смеси.
- Степень превращения Um , представленная через массовые доли:

где m0 - масса компонента в исходном потоке;
m - масса компонента в реакционной смеси.
- Факторы, влияющие на степень превращения:
- tр - продолжительность химической реакции;
- С0 - концентрации исходных веществ;
- подбор катализатора;
- величина потока рециркуляции.
2. Выход продукта.
- Определение выхода продукта Х:

где
mф - масса фактически полученного продукта;
mт - масса теоретически возможного количества продукта из данного исходного вещества.
- Факторы, влияющие на выход продукта Х:
Р - давление;
Сi - состав реакционной смеси;
tпр - время пребывания реакционной смеси в аппарате.
- Выход продукта характеризует:
- экономические показатели технологического процесса: чем ближе Х ® 1, тем лучше экономические показатели реакторного процесса.
3. Избирательность химического процесса.
- Избирательность химического процесса Из характеризует долю исходных веществ, превращенных в целевой продукт, по отношению к общему количеству химически превращенных исходных веществ:

где


- Избирательность влияет на экономические показатели процесса.
- Скорость химического процесса - это количество вещества, которое реагирует или образуется в единицу времени в единице объема (или на единице поверхности):

где

определяемая для химических реакций как произведение концентраций компонентов в степенях, равных их стехиометрическим коэффициентам;
К - константа скорости реакции,
определяемая на основании уравнения Аррениуса.
- Скорость процесса характеризует производительность химического реактора.
- Основные факторы, влияющие на скорость реакции:
- ? - температура;
- Р - давление.
Схема реактора непрерывного действия с мешалкой
с экзотермической реакцией 1-го порядка А ® В.
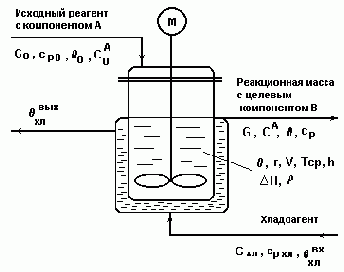
Рис.4.1.
- Показатель эффективности реакторного процесса в общем случае - концентрация целевого продукта в реакционной смеси СВ .
- Цель управления в общем случае:

- Цель управления для данного процесса:

- Обозначения на рис.4.1:
- cp0 , cp , cpхл - удельные теплоемкости соответствующих потоков, дж/(кг*град);
- r - плотность реакционной смеси, кг/м3 ;
- q0 ,q , qхл - температуры исходного реагента, реакционной смеси и хладоагента;
-

- V - объем реакционной смеси, м3 ;
- h - уровень реакционной смеси, м;
- Tср - среднее время пребывания реакционной массы в реакторе;

- -DH - тепловой эффект экзотермической реакции, дж/кг;
- r - скорость химической реакции, кг/(м3*с).
Математическое описание реактора
на основе физико-химических особенностей процесса.
Стехиометрическое уравнение химической реакции.
- Стехиометрическое уравнение химической реакции, характеризующее ее материальный баланс:

- Стехиометрическое уравнение для данного реактора:

где ai , bi , a , b - стехиометрические коэффициенты, числа реагирующих молей компонентов процесса.
Уравнение кинетики химической реакции.
- Результирующая скорость обратимой реакции:

где





ZА и ZВ - эмпирические коэффициенты;
ЕА и ЕВ - энергии активации.
- Кинетика для реактора типа рис.4.1:

- скорость обратного процесса:

Уравнение гидродинамики процесса.
- Уравнение гидродинамики процесса характеризует давление в потоке как сложную функцию:

где
x, z - координаты потока;
m - ламинарная вязкость, характеризующая силы внутреннего трения;
k - турбулентная вязкость;
r - плотность реакционной массы;
V - объем реакционной массы;
t - текущее время.
Материальный баланс реакторного процесса
по всему веществу.
Уравнение динамики:

где
Уравнение статики при


- На основе(1) и (2):

Материальный баланс реакторного процесса
по расходуемому веществу А.
Уравнение динамики:

где
I - изменение количества вещества А в реакторе в единицу времени;
II - количество вещества А, поступающего в реактор в единицу времени;
III - количество вещества А, отводимого из реактора в единицу времени;
IV - количество вещества А, расходующегося в реакторе на химическую реакцию в единицу времени, где V=S*h.
Уравнение статики при


- На основе (4) и (5):

Тепловой баланс реакторного процесса.
Уравнение динамики:

где
- I - изменение количества тепла в реакторе в единицу времени;
- II - количество тепла, поступающего в реактор с исходным реагентом в единицу времени;
- III - количество тепла, отводимого из реактора с реакционной массой в единицу времени;
- IV - количество тепла, выделяющегося в реакторе в результате химической реакции в единицу времени;
- V - количество тепла, отводимого из реактора с хладоагентом в единицу времени.
Уравнение статики при


- На основании (7) и (8):

Информационная схема реактора на основе балансовой модели.
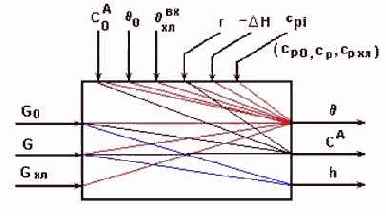
Рис.6.1.
- Возможные управляемые переменные: .

- Возможные управляющие воздействия: .

- Возможные контролируемые возмущения: .

- Возможные неконтролируемые возмущения: .

